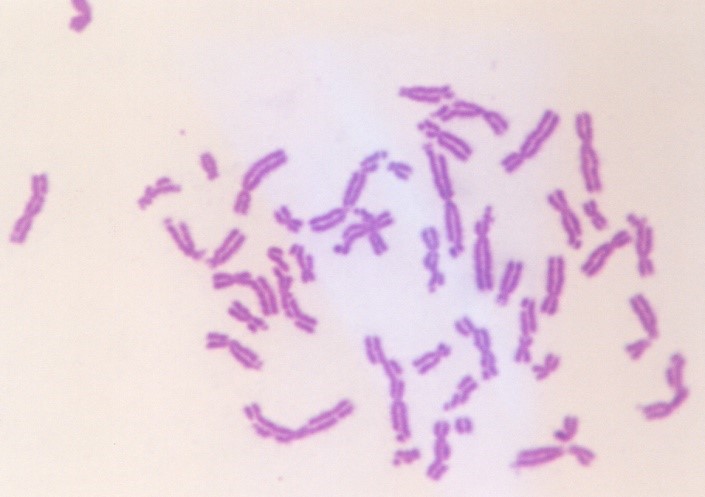
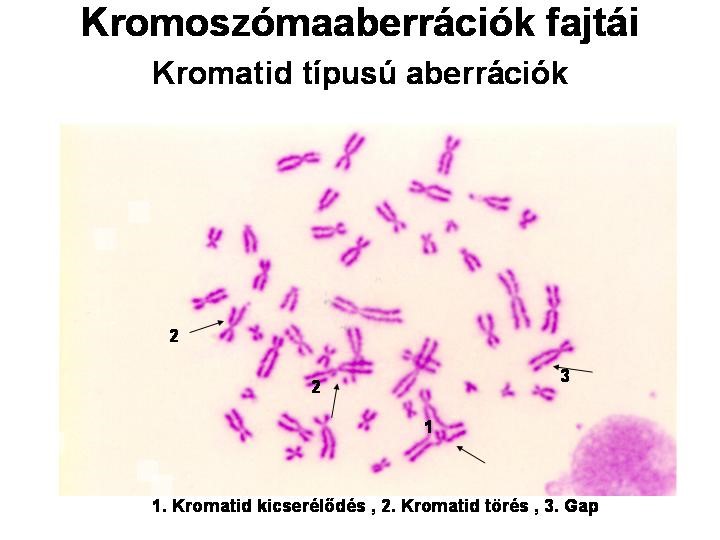
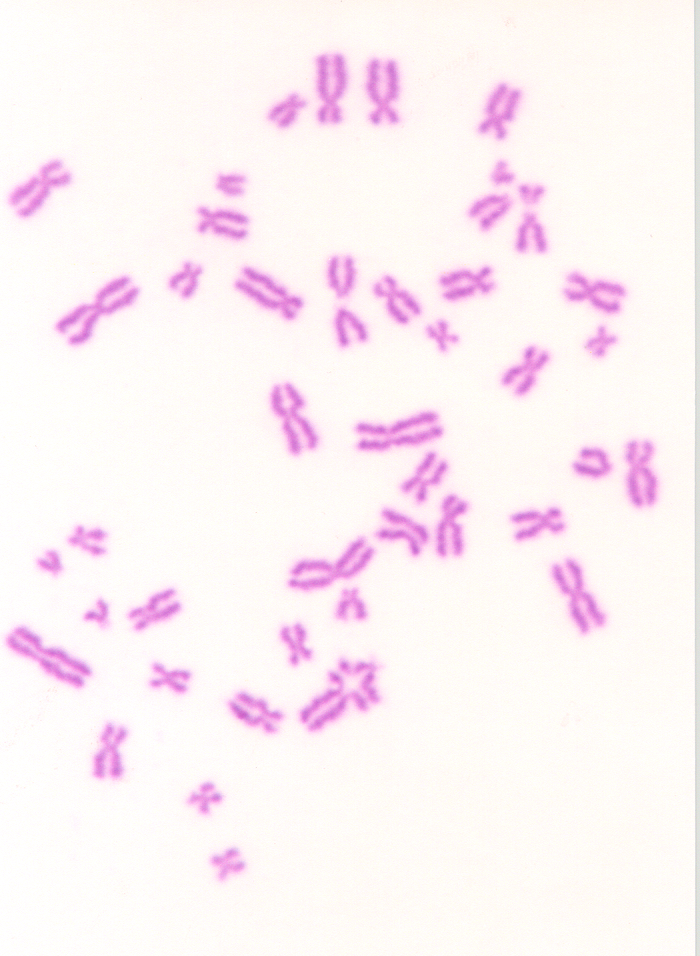
Tevékenységek
klinikai vizsgálatokban való részvétel
a sugárveszélyes munkahelyeken, és citosztatikummal dolgozók preventív célú citogenetikai szűrése
egyes hematológiai betegségek (pl. Fanconi anemia) diagnosztizálásának elősegítése
in vitro sugárbiológiai kutatások folytatása
Munkatársak
Dr. Jurányi Zsolt Ph.D., osztályvezető
Dr. Farkas Gyöngyi Ph.D., osztályvezető helyettes
Dr. Kocsis S. Zsuzsa Ph.D.
Dr. Sándor Gyöngyvér Orsolya Ph.D.
Székely Gábor, biológus
Vass Nagyezsda, laboratóriumi szakasszisztens
Kiss Krisztina, laboratóriumi szakasszisztens
Fodor Martin, laboratóriumi szakasszisztens
Klinikai kutatás
Tripla negatív emlőrákos (TNBC) betegek komplex terápiája során fellépő immunsejt-alpopuláció változások (immunterápia prediktív biomarkerei) vizsgálata
Az immunterápiák előretörésével egyre fontosabb tudni, hogy a további, előtte vagy vele párhuzamosan végzett kezelés típus hogyan változtatja meg a fehérvérsejtek számát és arányát, amelyekre az immunterápia hatásának kialakulásához szükség van. Ha túl kevés azoknak a sejteknek a száma, amiket fel kívánunk használni az immunterápiához, mert egy másik terápia során elpusztultak, akkor a kezelés hatástalan lehet. Szintén fontos lenne olyan értékeket találni, amik előre megmutatják, hogy ki fog reagálni az immunterápiára. Így megóvhatnánk a nem reagáló pácienseket annak mellékhatásaitól és az egészségügyi rendszert a felesleges terápiák költségeitől. Ezért 2021 szeptemberétől tripla negatív emlőrákos (TNBC) betegeket toborzunk és vérmintákat gyűjtünk a terápia kezdetét megelőzően és minden terápia típus után: kemoterápia után, műtét után, esetleges sugárkezelés után, capecitabine kemoterápia után, és az összes kezelés befejezését követően három hónappal, és mérjük a különböző immunsejt alcsoportok változását a különböző terápiák hatására. Összevetjük a betegek vérében mért sejtcsoportok tulajdonságait az adott egyének terápiákra adott válaszaival.
Szakembereknek
Amellett, hogy nagy szükség lenne a mostaninál hatékonyabb prediktív immunterápiás markerekre, a perifériás vérből mérhető biomarkerek előnyösebbek lennének, mivel könnyen hozzáférhetők és reprodukálhatók. Vizsgálatunkban több mint hetven sejtpopulációt analizálunk, beleértve a T-sejteket, NK alpopulációkat, Treg sejteket hat fluoreszcens panelben. Mérjük a jelenleg használt immunterápiák által célzott T-sejteket (PD1+, PDL1+, CTLA4+), de olyan immunsejteket is analizálunk, amelyekre célzott terápiás eljárások kidolgozás alatt állnak. Továbbá vizsgáljuk, hogy a fenti paraméterek milyen összefüggésben vannak hosszú távon a különböző terápiákra és a teljes kezelési folyamatra adott válasszal.
Sugárérzékenység mérés méhnyak tumoros betegekben (RILAc study)
A sugárterápia a daganatok nagyjából felének kezelésében szerepet játszik. Azonban még a legfejlettebb technikák mellett is előfordulnak mellékhatások, amelyek gyakorisága és súlyossága még ma sem megjósolható.
Ebben a vizsgálatban egy olyan módszert fejlesztünk, ami a kezelés előtt kijelölné azokat a betegeket, akiknél súlyos mellékhatások előfordulhatnak és esetleg módosulhatna a terápiájuk (adaptív kezelés, brachyterápia, sugárkezelés helyettesítése, ahol lehetséges, stb.). Szeretnénk felmérni, hogy valóban előre jelezhetőek-e a mellékhatások ezzel a méréssel, illetve szeretnénk a módszert minél könnyebben használhatóvá tenni. Ehhez méhnyaktumoros betegek részvételét kérjük, akik a kemoterápiával kiegészített sugárkezelés előtt adnak vérmintát, illetve a teljes kezelés lezárulta után 3, 12, 24 hónappal. Ezen kívül nemzetközileg elfogadott kérdőíveket töltetünk ki az esetleges mellékhatások felmérésére.
Szakembereknek
A sugárzás által kiváltott limfocita apoptózis (RILA) módszer egy klinikailag tesztelt vizsgálat az egyéni sugárérzékenység meghatározására. A besugárzott sejtek típusuktól és más tényezőktől függően függően például szeneszcenssé válhatnak vagy apoptózissal elhalhatnak. Egyes elméletek szerint a sugárkezelés miatt a fibroblasztok szeneszcens sejtekké alakulása okozza a mellékhatások túlnyomó részét, így minél több apoptotikus sejt van egy beteg vérében a besugárzást követően, annál kevesebb szeneszcens sejt és mellékhatás fordul elő.
A módszert már több száz emberen validálták multicentrikus vizsgálatokban. Nagy áteresztőképességű, gyors és olcsó technika. A mérés során 8 Gy besugárzás után mérjük az apoptotikus CD8+ és CD4+ limfocitákat propidium jodiddal festve áramlási citométeren. Teszteljük a 4 napos tenyésztés szükségességét, a CO2 hozzáadásának szükségességét, és az iv vitro besugarazás esetleges helyettesítését bleomycinnel.
Vérben keringő endotél és endotél progenitor sejtek vizsgálata visszaesés (relapszus) kimutatására glioblasztómás betegekben (MRI vizsgálat kiváltására)
A glioblasztóma nevű agytumor műtéti és sugárkezelése után az esetleges visszaesés kizárásához a betegeknek gyakran kell MRI vizsgálatokon részt venniük. Ez a beteg számára kényelmetlen, és az egészségügyi rendszer számára költséges. A vérben megtalálhatóak olyan sejtek, amik előre jelezhetik az állapotromlást és amennyiben ez bizonyítható, mérésük kiválthatja az MRI vizsgálatokat.
A vizsgálatba olyan glioblasztómás betegeket szeretnénk bevonni, akik sugárkezelés előtt állnak vagy akik visszatérő glioblasztóma tumor miatt az anti-VEGF kezelés előtt állnak, valamint olyan betegeket, akik több, mint hat hónapja kapják az anti-VEGF terápiát.
Szakembereknek
Bizonyos keringő endotél és endotél progenitor sejtekről kimutatták, hogy az angiogenezis gátló kezelés hatásosságának elvesztését előre jelezhetik. A vizsgálatban ilyen sejteket vizsgálunk (16 alpopulációt) mind anti-VEGF terápia alatt álló betegeken (a terápiát kezdő és arra hosszabb ideje jól reagáló betegeken pozitív kontrollként) és a vizsgálat kiterjesztéseképpen korábbi stádiumú sugárkezelést + temazolomidot (Stupp protokoll) kezdő betegekben. Vizsgáljuk, hogy a fenti paraméterek milyen összefüggésben vannak rövid és hosszú távon a terápiára adott válasszal, milyen prognosztikai és prediktív értékkel bírnak.
Prosztata tumoros betegek citogenetikai és immunológiai karakterizálása
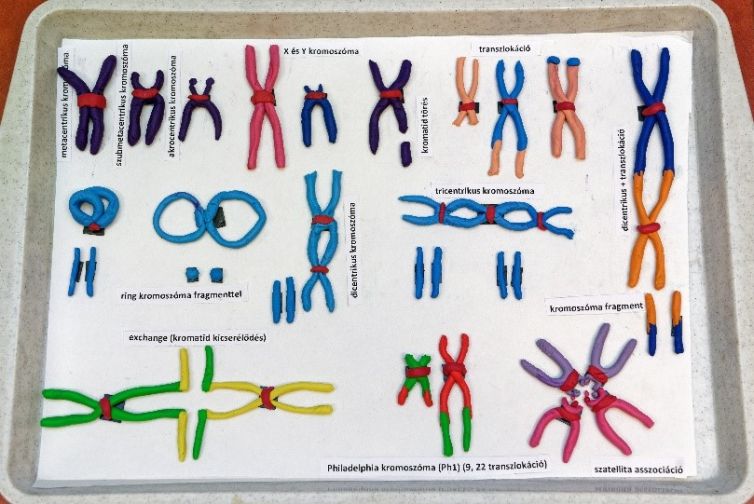
Intézetünkben a nem áttétes prosztata tumoros betegek számára négy féle sugárterápia is elérhető, azonban ezeknél más-más mellékhatás típusok más-más erősséggel jelentkezhetnek. Kutatásunkban összehasonlítjuk a mellékhatásokat a különböző terápiáknál, beleértve a vérben keringő fehérvérsejtek kromoszómakárosodásait. Vért veszünk azoktól prosztata tumoros betegektől, akik beleegyeztek a vizsgálatba és a tenyésztett fehérvérsejtekből tisztított kromoszómákat mikroszkópban vizsgáljuk. Továbbá, a különböző fehérvérsejt típusok különböző sugárterápiákra adott válaszát együttműködő partnereinkkel közösen vizsgáljuk.
Szakembereknek
A jelenlegi sugárterápiás technikák biológiai dózisait eddig nem hasonlították össze hosszú távon. Az elnyelt biológiai dózist leginkább a limfociták károsodásával (mikronukleusz vizsgálat, Comet-assay, kromoszómaaberráció vizsgálat) kvantifikálhatjuk, ezáltal leírhatjuk az immunsejtek állapotát is. Az immunterápia egyre több beteg számára elérhető, az immunterápiás készítményekkel megcélzott limfociták károsodása fontos tényező lehet a sikerességi arányban. Kevés információ áll rendelkezésre arról is, hogy mennyi időbe telik a károsodott sejtek eltűnése a vérből. Lokalizált prosztatarákkal diagnosztizált betegeket vizsgálunk (N=251), akik négy különböző technikával kaphatnak sugárterápiát intézetünkben (teleterápia hagyományos LINAC vagy Cyberknife készülékkel, magas vagy alacsony dózisú brachyterápiával). Vizsgálatunkban a négyféle sugárterápiát a biológiai dózis és a mellékhatások szempontjából is összehasonlítjuk. Az öt éves követés (9 mintaponttal) lehetőséget ad a sérült limfociták vérből való kiürülésének megfigyelésére.
A Nemzeti Népegészségügyi Központ Sugárbiológiai és Sugáregészségügyi Főosztályával együttműködésben végezzük a prosztata tumoros betegek immunsejt alpopulációinak vizsgálatát. Például, a killer T-sejtek aktivációs állapotát, szeneszcencia felé való elmozdulását, az NK sejtek érettségét, a regulátor T-sejtek és MDSC (myleoid-derived suppressor cell) jelenlétét vizsgáljuk. Szolubilis markerek mérésével és genetikai elemzésekkel kiegészítve az áramlási citométeres analíziseket arra keressük a választ, hogy a sugárterápia összességében milyen hatást fejt ki az immunrendszerre, hosszú távon.
Citogenetikai szűrés
Citogenetikai szűrés a sugárzással és veszélyes kémiai anyagokkal (citosztatikumokkal) dolgozók körében (orvosok, fizikusok, sugárterápiás asszisztensek, izotóp- és laboratóriumi személyzet)
Szűrővizsgálat keretében végzünk kromoszómaaberrációs mérést, amelyet kétévente javasolnak minden olyan személy számára, akik citosztatikus szerekkel vagy ionizáló sugárzással dolgoznak. A kromoszómaaberráció értékek alapján egyrészt becsülhető a szervezet által kapott sugárzási dózis, illetve tudjuk, hogy számos vegyszer is okoz aberrációt. Ismert továbbá, hogy a kromoszóma hibák jelenléte a tumor kialakulás kockázatával van párhuzamban. A kromoszómaaberrációk vizsgálata lehetővé teszi a megelőzést és a kockázat csökkentését, például a kémiai és sugár expozíció kimutatása után lehetséges a kitettség csökkentése, illetve egyéni érzékenység esetén felmerülhet a munkakör váltás.
Főként intézeti dolgozókat vizsgálunk, de szerződés vagy külön megállapodás keretében külső munkahelyek vagy magánszemélyek is kérhetik a vizsgálatot (Dr. Jurányi Zsolt Ph.D., osztályvezetőt keressék a részletekért a +361 224 8779 számon vagy juranyi.zsolt@oncol.hu címen).
Szakembereknek
A vizsgálat perifériás vér limfocitákban történik és csak Li-heparinos cső alkalmas a vérvételre, mert csak ebben az esetben zárható ki a véralvadás gátló DNS-törő hatása. Fontos továbbá, hogy ha foglalkozásegészségügyi vizsgálat történik, mindenképpen a tüdő röntgen előtt történjék a vérvétel, mert a sugárdózis okozta károsodás elfedheti a már jelenlevő hibákat. A módszer Giemsa festést használ, kromoszómaszám ellenőrzésére alkalmas, de nem alkalmas kariotipizálásra. Bár genetikai elváltozásokra utaló jeleket alkalmanként ki tudunk mutatni, de a módszer célja az expozíció, illetve az emelkedett rákkockázat jelzése.
Hematológiai betegségek differenciáldiagnózisának támogatása (például Fanconi-anémia)
A szervezetben a csontvelőben történik az oxigénszállítást végző vörösvértestek, az immunitást biztosító fehérvérsejtek és a véralvadásban szerepet játszó vérlemezkék (trombociták) termelődése. A csontvelő károsodása esetén ezek a folyamatok igen jelentős mértékben lelassulhatnak, aminek következtében aplasztikus anémiának nevezett állapot lép fel. A csontvelő elégtelenség következtében túl kevés lesz a vérben a vörösvértestek, a fehérvérsejtek és a vérlemezkék száma egyaránt (anémia + leukopénia + trombocitopénia = pancitopénia). Ebben az esetben csontvelő átültetést kell végrehajtani, de előtte a beteg maradék, még működő csontvelő állományát el kell pusztítani. Erre a célra különböző kémiai anyagokat vagy besugárzást használnak. Ugyanakkor a betegség egyes formáiban a csontvelő elpusztítása a beteg halálához vezethet, mielőtt még transzplantációra kerülne sor. Ezek a betegek kiszűrhetők kromoszóma analízis segítségével és megelőzhető náluk a végzetes esemény bekövetkezése.
Szakembereknek
Az aplasticus anémia szerzett, idiopathiás formáját és a recesszíven öröklődő, malignitásra különösen hajlamosító típusát, a Fanconi-anémiát tudjuk megkülönböztetni az indukált kromoszómaaberrációs módszerrel. A szerzett és öröklött aplasticus anémia variációk gyógyítása elsősorban csontvelő transzplantációval történik. A betegek kondicionáló kezelése során a csontvelő kiölése azonban igen nagy körültekintést igényel, hiszen Fanconi-anémia esetén a beteg a veleszületett repair-deficiencia miatt hiperszenzitíven (akár letálisan) reagálhat a nagydózisú alkiláló kemoterápiás kezelésre vagy az egésztest besugárzásra. A differenciál diagnózishoz mitomycin-C-vel in vitro indukált fragilitást vizsgálunk, ami Fanconi anemia esetében markánsan magasabb, mint a szerzett aplasticus anemia formáiban. A spontán kromoszóma törékenység és a különféle in vitro expozíciókkal indukált kromoszóma fragilitás különböző módon jelenik meg más ritka, recesszíven öröklődő hematológiai kórképekben is (Bloom-szindróma, Ataxia teleangiectasia, Nijmegen-törékenységi szindróma, stb).
In vitro kutatási tevékenység
A daganatok sugárrezisztenciájának kutatása
A sugárterápia sikerének egyik gátja, hogy a tumorokban kialakulhatnak olyan sejtek, amik nem érzékenyek már a sugárzásra (rezisztensek). Az egészséges sejtekben is képződnek un. szabadgyökök, amelyek sokkal nagyobb mennyiségben vannak jelen a daganatos sejtekben. A szabadgyök káros, ezért a sejtek igyekeznek megszabadulni tőle, ez a folyamat a daganatos sejtekben fokozottan zajlik, ami egyfajta védelmet ad a sejteknek például a sugárterápiával szemben. Ezen kívül ezek a sejtek máshogyan osztódhatnak, vagy hatékonyabban javíthatják a sugárzás okozta DNS károsodásokat. Mi a tumorban végbemenő változásokhoz hasonló módon viselkedő sejtvonalon vizsgáljuk, hogy melyek a lényeges változások a daganatos sejtekben és keressük a beavatkozási pontokat, amelyen keresztül a sugárérzékenység visszaállítható lenne.
Szakembereknek
Előállítottunk egy sugárrezisztens emlőtumoros sejtvonalat ismétlődő besugárzás – növesztés ciklusokkal. Ezen a sejtvonalon vizsgáljuk például a ROS eltávolító redoxrendszerek, és a DNS hibajavítási és a sejtciklus szabályzás génjeinek kifejeződését. Ezen kívül fehérjeszinten a cisztein rendszer fehérjéit vizsgáltuk, valamint áramlási citométerrel figyeljük a sejtciklusban való elhelyezkedést és ennek változását besugárzás hatására. Összehasonlítjuk továbbá a teljes ROS mennyiség és a glutation koncentráció időfüggő változását a kiindulási és a rezisztens törzsben.
A CT-vizsgálatok biológiai dózisának mérése az adaptív sugárterápiában
Az adaptív sugárterápia egy olyan módszer, amikor minden kezelési napon – a daganat méretének változását figyelembe véve – módosítják a besugárzási tervet, hogy a legnagyobb pontosságal találja el sugárzás a tumort és kerülje a közeli, egészséges szöveteket. A kezelés kezdetén az orvosok és fizikusok megtervezik, hogyan kaphatja a tumor a legnagyobb mértékű sugárzást úgy, hogy ne károsodjanak a közeli szervek. Azonban, ahogy a daganat mérete csökken vagy bizonyos szervek (belek, húgyhólyag) mozog, másnap már kicsit máshol lehetnek a szervek és a tumor. Ezért egy mesterséges intelligencia segítségével minden nap hozzáigazítják a tervet az aznapi elhelyezkedéshez. Ehhez sok CT vizsgálat készül, ami módosíthatja a leadott sugárzás dózisát. Mivel a testre ható biológiai dózisok nem egyszerű összeadással összegezhetők, ezért kísérleteket végzünk a végleges összdózis megállapítására.
Szakembereknek
A Cone Beam Computed Tomography (CBCT)-t rutinszerűen alkalmazzák a sugárterápiában a céltérfogat meghatározásához. Azonban a kis dózisú és más energiájú plusz sugárzás nem egyértelműen adható hozzá a sugárkezelés dózisához. Különösen fontos ez az adaptív sugárkezelésnél, ahol minden kezelési napon készül CBCT. Kutatásunk célja a CBCT-dózis és az aktuális sugárterápiás dózis együttes biológiai hatásainak meghatározása in vitro kromoszóma dozimetria segítségével. (A vizsgálat a sugárzásfizikusokkal való együttműködés keretében valósul meg.)
Kutatási támogatások
Befektetés a jövőbe NKFI 2020-1.1.6-JÖVŐ
Nemzeti Laboratóriumok Program NKFI 2022-2.1.1-NL-2022-00010
Tématerületi Kiválósági Program NKFI TKP2021-EGA-44
Oktatás
Osztályunk kutatási tevékenységében aktív szerepet vállalnak egyetemi hallgatók is, a TDK munka eredményeként eddig több BSc és egy MSc fokozat megszerzése történt
Kiket várunk?
Biomérnök és természettudományi/egészségügyi tanulmányokat folytató hallgatókat.
Miért jó ez neked?
Saját kutatási tevékenység szakdolgozat lehetőséggel. Labormunka korlátlan gyakorlása. Steril fülke, centrifuga, (fluoreszcens) mikroszkóp, flow citométer használatának elsajátítása. Részvétel egy klinikai kutatólaboratórium mindennapjaiban.
Részt veszünk az Onkológiai Intézetben rendszeresen megtartott beteg oktatási programban, ahol a daganatos betegségek kialakulásának okairól, azok kezelési lehetőségeiről, az esetleges mellékhatásokról, valamint a megfelelő táplálkozás fontosságáról tartunk előadásokat, közérthető módon.
Tudományos ismeretterjesztés
2016 óta minden évben szervezzük az Országos Onkológiai Intézet részvételét a Kutatók Éjszakája programsorozatban. Az ikonra kattintva az MTV M1 hírműsorában készített beszélgetés tekinthető meg a témában.

Publikációk (MTMT linkek)
Dr. Jurányi Zsolt
MTMT: https://m2.mtmt.hu/gui2/?type=authors&mode=browse&sel=authors10010426
Dr. Kocsis S. Zsuzsa
MTMT: https://m2.mtmt.hu/gui2/?type=authors&mode=browse&sel=authors10020433
Dr. Farkas Gyöngyi
MTMT: https://m2.mtmt.hu/gui2/?type=authors&mode=browse&sel=authors10011699
Dr. Sándor Gyöngyvér Orsolya
MTMT: https://m2.mtmt.hu/gui2/?type=authors&mode=browse&sel=authors10070301
Székely Gábor
MTMT: https://m2.mtmt.hu/gui2/?type=authors&mode=browse&sel=authors10032265